Скорость химической реакции закон действующих масс
В 1865 г. профессор Н.Н. Бекетов впервые высказал гипотезу о количественной взаимосвязи между массами реагентов и временем течения реакции: «. притяжение пропорционально произведению действующих масс». Эта гипотеза нашла подтверждение в законе действующих масс, который был установлен в 1867 г. двуми норвежскими химиками К. Гульдбергом и П. Вааге. Современная формулировка закона действующих масс такова:
При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для реакции aA + bB → mM + nN математическое выражение закона действующих масс имеет вид:
где v — скорость реакции; k — коэффициент пропорциональности, называемый константой скорости химической реакции (при CA = CB = 1 моль/л k численно равна v); CA и CB — концентрации реагентов A и B; a и b — стехиометрические коэффициенты в уравнении реакции.
Константа скорости химической реакции k определяется природой реагирующих веществ и зависит от температуры, от присутствия катализатора, но не зависит от концентрации веществ, участвующих в реакции.
Закон действующих масс справедлив только для наиболее простых по своему механизму взаимодействий, протекающих в газах или в разбавленных растворах.
Часто уравнение реакции не отражает ее механизма. Сложные реакции могут быть совокупностью параллельно или последовательно протекающих процессов. Закон действующих масс справедлив для каждой отдельной стадии реакции, но не для всего взаимодействия в целом. Та стадия скорость которой минимальна, лимитирует скорость реакции в общем. Поэтому математическое выражение закона действующих масс, записанное для самой медленной (лимитирующей) стадии процесса, приложимо одновременно ко всей реакции в целом.
Примеры решения задач:
Задача 1. Во сколько раз изменится скорость прямой и обратной реакций в системе 2SO2(г) + O2 = 2SO3(г) , если объем газовой смеси уменьшить в 3 раза? В какую сторону сместится равновесие системы?
Решение. Обозначим концентрации реагирующих веществ CSO2 = a, CO2 = b, CSO3 = d. Согласно закону действующих масс, скорости прямой и обратной реакций до изменения объема:
После уменьшения объема гомогенной системы в 3 раза концентрация каждого из реагирующих веществ увеличится в 3 раза: CSO2 = 3a, CO2 = 3b, CSO3 = 3d. При новых концентрациях скорости прямой и обратной реакций:
v’прямая = k1 · (3a) 2 · 3b = 27 · k1 · a 2 · b;
Изменения скоростей составят:
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной — в 9 раз. Равновесие системы сместилось в сторону образования SO3.
Источники информации:
- Коровин Н.В., Масленникова Г.Н., Мингулина Э.И., Филиппов Э.Л. Курс общей химии. — М.: Высшая школа, 1990. — С. 109-110, 140-141
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Кипер Руслан
chemister.ru
Закон действия масс
Взаимодействие между различными веществами происходит при различных условиях и с различной скоростью. Понятие о скорости химической реакции является одним из важнейших в химии. Скорость химической реакции характеризуется изменением концентрации реагирующих веществ за единицу времени. Концентрация выражается числом молей в 1 л, время — секундами, минутами или часами в зависимости от скорости данной реакции.
Так как все реагирующие вещества связаны между собой уравнением реакции, по изменению концентрации одного вещества можно судить об изменениях концентрации всех остальных. Например, исходная концентрация одного из реагирующих веществ составляла 2 моль/л, а через 5 мин от начала реакции она стала 1,5 моль/л; таким образом средняя скорость реакции
будет равна (2-1,5)/5=0,1 моль/л в минуту.
Для того чтобы произошло химическое взаимодействие веществ, молекулы или ионы должны столкнуться. Только при этом станет возможным образование молекул новых веществ (продуктов реакции). Ясно, что скорость реакции будет пропорциональна числу столкновений, которое будет тем больше, чем выше концентрация реагирующих веществ.
В 1867 г. К. М. Гульберг и П. Вааге открыли так называемый закон действия масс, устанавливающий зависимость скорости химической реакции от концентрации. Согласно этому закону скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ.
Так, для реакции А+В=АВ выражение для скорости реакции будет иметь вид
где V — скорость реакции; [А] — концентрация вещества А; [В]—концентрация вещества В; k — коэффициент пропорциональности, или константа скорости.
Опыт показывает, что скорость химической реакции зависит от температуры, причем при повышении температуры скорость большинства реакций увеличивается. Это объясняется тем, что при повышении температуры увеличивается скорость движения молекул, а следовательно, и число столкновений между ними. Кроме того, скорость реакции зависит от природы реагирующих веществ.
Эти два фактора влияют на величину константы скорости и, следовательно, она зависит от температуры и природы реагирующих веществ, а также от присутствия катализатора.
Если [А]=1 и [В]=1, то V=k. Константа скорости k численно равна скорости данной реакции, если концентрации реагирующих веществ или их произведение равны единице.
Если 2 моля вещества А вступят в реакцию с 3 (молями вещества В, т. е. 2А +ЗВ = С, то скорость данной реакции
Таким образом, для реакции
выражение для скорости реакции будет следующее:
Например, скорость реакции окисления оксида азота равна
У нас можно купить кедровые орехи из свежего урожая.
Вместо телевизора, теперь доступно бесплатное тв онлайн.505days.com


5.2. Закон действующих масс
Скорость реакции в момент τ – мгновенная скорость V τ – подчиняется закону действующих масс, который был экспериментально открыт и теоретически обоснован в середине XIX столетия и получил свое название от термина «действующая масса» – синонима современного понятия «концентрация».
Рассмотрим взаимодействие молекулы А с молекулой В в неком объеме (рис. 5.1).
Пусть реакция происходит в некоторой точке R через предшествующее взаимодействию столкновение. Если молярные концентрации веществ А и В выразить через их символы в квадратных скобках, то вероятность нахождения веществ А в точке R будет пропоциональна [A], т. е. ωA=α[A]. Вероятность ωB нахождения вещества в этой точке равна ωB = β[B], а вероятность их одновременного присутствия в точке R (точке столкновения) равна произведению ωA∙ωВ = α[A]∙β[B]. Поскольку только часть столкновений приводит к химической реакции, то скорость реакции образования АВ равна V AB = γ∙α[A]∙β[B] = γ α β [A] [B] . Обозначив γ·α·β = k , получаем для реакции A + B, V AB = k [A] [B]
Коэффициент пропорциональности называют константой скорости . Очевидно, для реакции a A + b B, то есть для a молей вещества А и b молей вещества В ЗДМ формально запишется в виде

Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов. Это определение относится к гомогенным реакциям. Если реакция геторогенная (реагенты находятся в разных агрегатных состояниях), то в уравнениие ЗДМ входят только жидкие или только газообразные реагенты, а твердые исключаются, оказывая влияние только на константу скорости k . Константа скорости k численно равна скорости, если концентрации реагентов постоянны и равны единице.

Закон действующих масс безусловно выполняется только для элементарных химических реакций, протекающих в одну стадию. В других случаях фактическая и вычисленная по закону действующих масс скорости совпадают редко.
chemistry.ru

Владельцы сайта
- Галина Пчёлкина
- Реакция активируется термично, т.е. энергией теплового движения молекул.
- Концентрация реагентов распределена равномерно.
- Свойства и условия среды в ходе процесса не меняются.
- Свойства среды не должны влиять на k.
Обратная связь

Урок №23. Понятие о скорости химической реакции. Катализаторы.
Вы знакомы с понятием «скорость» из курса физики. В общем виде скорость — это величина, показывающая как изменяется какая либо характеристика за единицу времени.
Скорость химической реакции — это величина, показывающая как изменяются концентрации исходных веществ или продуктов реакции за единицу времени.
Для оценки скорости необходимо изменение концентрации одного из веществ.
1. Наибольший интерес представляют реакции, протекающие в однородной (гомогенной) среде.
Гомогенные системы (однородные) – газ/газ, жидкость/жидкость – реакции идут во всём объёме.
Математически скорость химической гомогенной реакции можно представить с помощью формулы:

2. Для гетерогенной реакции, скорость реакции определяется числом молей веществ, вступивших в или образующихся в результате реакции в единицу времени на единице поверхности:

Гетерогенные (неоднородные) системы – твёрдое/жидкость, газ/твёрдое, жидкость/газ – реакции идут на поверхности раздела фаз.
Таким образом, скорость химической реакции показывает изменение количества вещества в единицу времени, в единице объёма или на единице поверхности раздела фаз.
Зависимость скорости реакций от различных факторов
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
aA +bB = cC + dD, где A , B , C , D – газы, жидкости
Для данной реакции кинетическое уравнение принимает вид:
Причиной повышения скорости является увеличение числа столкновений реагирующих частиц за счёт увеличения частиц в единице объёма.
Химические реакции, протекающие в гомогенных системах (смеси газов, жидкие растворы), осуществляется за счет соударения частиц. Однако, не всякое столкновение частиц реагентов ведет к образованию продуктов. Только частицы, обладающие повышенной энергией — активные частицы, способны осуществить акт химической реакции. С повышением температуры увеличивается кинетическая энергия частиц и число активных частиц возрастает, следовательно, химические реакции при высоких температурах протекают быстрее, чем при низких температурах. Зависимость скорости реакции от температуры определяется правилом Вант — Гоффа : при повышении температуры на каждые 10°С скорость реакции увеличивается в 2-4 раза .
Правило Вант — Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции.
Ингибитор — вещество, замедляющее скорость реакции
площадь соприкосновения реагирующих веществ
Для увеличения площади соприкосновения реагирующих веществ, их измельчают. Наибольшей степени измельчения достигают путем растворения веществ. Быстрее всего вещества реагируют в растворах.
природа реагирующих веществ
Например, металлы магний и железо реагируют с соляной кислотой одинаковой концентрации с различной скоростью. Это связано с разной химической активностью металлов.
при наличии газообразных реагентов — повышение давления повышает концентрацию газообразных веществ, увеличивая скорость реакции.
sites.google.com
Скорость химической реакции
Говорить об осуществимости процесса можно по изменению энергии Гибсса системы. Но данная величина не отражает настоящую возможность протекания реакции, ее скорость и механизм.
Для полноценного представления химической реакции, надо иметь знания о том, какие существуют временные закономерности при ее осуществлении, т.е. скорость химической реакции и ее детальный механизм. Скорость и механизм реакции изучает химическая кинетика – наука о химическом процессе.
С точки зрения химической кинетики, реакции можно классифицировать на простые и сложные.
Простые реакции – процессы, протекающие без образования промежуточных соединений. По количеству частиц, принимающих в ней участие, они делятся на мономолекулярные, бимолекулярные, тримолекулярные. Соударение большего чем 3 числа частиц маловероятно, поэтому тримолекулярные реакции достаточно редки, а четырехмолекулярные — неизвестны. Сложные реакции – процессы, состоящие из нескольких элементарных реакций.
Любой процесс протекает с присущей ему скоростью, которую можно определить по изменениям, происходящим за некий отрезок времени. Среднюю скорость химической реакции выражают изменением количества вещества n израсходованного или полученного вещества в единице объема V за единицу времени t.
Если вещество расходуется, то ставим знак «-», если накапливается – «+»
При постоянном объеме:
Единица измерения скорости реакции моль/л·с
В целом, υ — величина постоянная и не зависит от того, за каким участвующим в реакции веществом, мы следим.
Зависимость концентрации реагента или продукта от времени протекания реакции представляют в виде кинетической кривой, которая имеет вид:
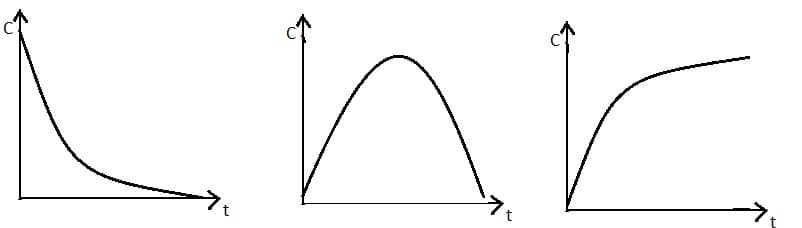
Вычислять υ из экспериментальных данных удобнее, если указанные выше выражения преобразовать в следующее выражение:

Закон действующих масс. Порядок и константа скорости реакции
Одна из формулировок закона действующих масс звучит следующим образом: Скорость элементарной гомогенной химической реакции прямо пропорциональна произведению концентраций реагентов.
Если исследуемый процесс представить в виде:
то скорость химической реакции можно выразить кинетическим уравнением:
а и b – стехиометрические коэффициенты простой реакции,
k – константа скорости реакции.
Химический смысл величины k — это скорость реакции при единичных концентрациях. То есть, если концентрации веществ А и В равны 1, то υ = k.
Надо учитывать, что в сложных химических процессах коэффициенты а и b не совпадают со стехиометрическими.
Закон действующих масс выполняется при соблюдении ряда условий:
К сложным процессам закон действия масс применить нельзя. Это можно объяснить тем, что сложный процесс состоит из нескольких элементарных стадий, и его скорость будет определяться не суммарной скоростью всех стадий, лишь одной самой медленной стадией, которя называется лимитирующей.
Каждая реакция имеет свой порядок. Определяют частный (парциальный) порядок по реагенту и общий (полный) порядок. Например, в выражении скорости химической реакции для процесса
а А + b В = продукты
a – порядок по реагенту А
Для простых процессов порядок реакции указывает на количество реагирующих частиц (совпадает со стехиометрическими коэффициентами) и принимает целочисленные значения. Для сложных процессов порядок реакции не совпадает со стехиометрическими коэффициентами и может быть любым.
Определим факторы, влияющие на скорость химической реакции υ.
Зависимость скорости реакции от концентрации реагирующих веществ
Очевидно, что с увеличением концентраций реагирующих веществ, υ увеличивается, т.к. увеличивается число соударений между участвующими в химическом процессе веществами. Причем, важно учитывать порядок реакции: если это n = 1 по некоторому реагенту, то ее скорость прямо пропорциональна концентрации этого вещества. Если по какому-либо реагенту n = 2, то удвоение его концентрации приведет к росту скорости реакции в 2 2 = 4 раза, а увеличение концентрации в 3 раза ускорит реакцию в 3 2 = 9 раз.
Зависимость скорости реакции от давления
определяется уравнением Клапейрона – Менделеева, которое связывает концентрацию и давление:
Таким образом, изменение концентрации в системе, а следовательно и скорости реакции имеет прямую зависимость от изменения давления. Эта зависимость актуальна в первую очередь для процессов, идущих с участием газов. Например, для реакции первого порядка, увеличение давления в 2 раза вызовет рост концентрации вещества в 2 раза, что непременно изменит υ – она станет в 2 раза больше.
Зависимость скорости реакции от площади поверхности
касается гетерогенных реакций. Вещества реагируют быстрее, если площадь поверхности, на которой может происходить взаимодействие веществ больше. Растворяя вещество, мы уменьшаем его размеры до размеров молекулы, увеличивая тем самым площадь поверхности. Поэтому химические процессы между веществами, находящимися в растворенном, жидком или газообразном состоянии имеют большую скорость, чем взаимодействия между твердыми веществами.
Зависимость скорости реакции от природы вещества.
Имеет большое значение строение электронной оболочки атома, тип химической связи и ее прочность в молекулах, структура вещества, прочность его кристаллической решетки. Известно, что натрий будет активнее взаимодействовать с водой, чем, например, олово. Поэтому и скорость взаимодействия натрия с водой выше скорости взаимодействия олова с водой.
Зависимость скорости реакции от температуры
определяется правилом Вант-Гоффа и уравнением Аррениуса. Повышая температуру, мы сообщаем молекулам дополнительную энергию (увеличивая, тем самым, энергию активации), которая способствует протеканию реакции. Сванте Аррениус в 1889 году, изучая зависимость υ от температуры, установил, что большинство химических процессов подчиняются уравнению:
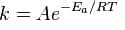
где k — константа скорости реакции
Еа -энергия активации – минимальная (критическая) энергия, необходимая для осуществления реакции, единица измерения Дж/моль
Т — абсолютная температура
R – газовая постоянная, R = 8,314 Дж/моль·град
A — предэкспоненциальный множитель (частотный фактор), единица измерения совпадает с k. Эта константа выражает вероятность того, что при столкновении молекулы будут ориентированы так, чтобы взаимодействие было возможно.
Часто бывает, что известна константа скорости при одной температуре Т1, а требуется найти k при некой другой температуре Т2. Это легко сделать, если взять логарифм уравнения Аррениуса при Т1 и Т2:
Вычитая второе равенство из первого, получаем: 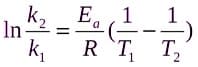
При определении скорости химической реакции, также можно использовать уравнение Аррениуса (в случае, если υ описывается степенным уравнением):
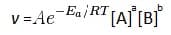
Если принять, что концентрации веществ А и В постоянны и прологарифмировать данное выражение, то получим следующее:
Также удобно пользоваться эмпирическим правилом, которое сформулировал Якоб Вант-Гофф: увеличение температуры на каждые 10 градусов, приводит к росту скорости реакции в 2 – 4 раза. Правило имеет математическое выражение:

γ — температурный коэффициент реакции, значения которого лежат в интервале от 2 до 4.
υT1/υT2 = 3 2 = 9. Это означает, что υ возросла в 9 раз.
Зависимость скорости реакции от присутствия катализатора
Катализ – это любое изменение скорости реакции под действием катализатора. Он может быть положительным и отрицательным. Суть катализа – генерирование активного субстрата или реагента с участием катализаторов.
Катализатор представляет собой вещество, которое селективно ускоряет химическую реакцию, вступая при этом в промежуточную стадию, но регенирируясь к ее концу (к моменту образования конечных продуктов). Например, в биохимической среде в качестве катализаторов выступают ферменты.
Если такое вещество замедляет химическую реакцию, то оно называется ингибитором.
Влияние катализатора на скорость реакции основывается на том, что он изменяет энергию активации Еа или А. Понижение энергии активации под действием катализатора схематично представлено на рисунке ниже:
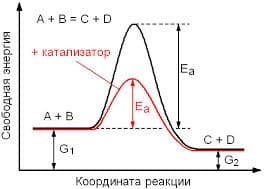 влияние катализатора на энергию активации
влияние катализатора на энергию активации
Видно, что веществам А и В требуется большое количество энергии, чтобы образовать конечные продукты. Но в присутствии катализатора для получения конечных продуктов требуется гораздо меньше энергии, т.к. идет понижение полной энергии активации, и тем самым, увеличение скорости реакции. Обращаю ваше внимание на то, что энергии как начальных, так и конечных веществ остаются одинаковыми в обеих реакциях.
zadachi-po-khimii.ru
